Bài viết của Thạc sĩ, Bác sĩ Phan Trúc - Bác sĩ Nội Ung bướu - Huyết học - Trung tâm Ung bướu - Xạ trị - Bệnh viện Đa khoa Quốc tế Vinmec Times City
Khởi đầu và diễn tiến của bạch cầu cấp dòng lympho (ALL) xuất phát từ sự đột biến thành công gây ra thay đổi chức năng tế bào, bao gồm tăng khả năng tự tái sinh, thoát khỏi sự kiểm soát tăng sinh bình thường, ngưng biệt hóa và tăng đề kháng với tín hiệu chết tế bào (apoptosis). Những rối loạn liên quan đến sửa chữa DNA có thể đóng vai trò quan trọng. Những tác nhân môi trường như bức xạ ion hóa, hóa chất sinh ung có liên kết rõ ràng với một số bệnh nhân ALL. Tuy nhiên, trong hầu hết trường hợp, không có yếu tố nguyên nhân nào là thấy rõ. Theo lý thuyết cộng hưởng, quá trình sinh leukemia phản ánh sự tương tác giữa yếu tố nhạy cảm cá nhân và yếu tố môi trường.
1. Tỷ lệ sinh bệnh bạch cầu cấp tính dòng Lympho
Hiệp hội ung thư Hoa kỳ (ACS) ước tính tại Mỹ có khoảng 6020 trường hợp mới mắc ALL năm 2014 (3140 nam và 2880 nữ) và xấp xỉ 1440 ca tử vong từ ALL (810 nam, 630 nữ). Hầu hết trường hợp ALL xảy ra ở trẻ em, nhưng tử vong do ALL chủ yếu ở người lớn (chiếm 4/5).
Tỉ lệ mắc ALL điều chỉnh theo tuổi là 1,6/100.000 nam/năm và 1,2 với nữ ở Mỹ, dựa vào những trường hợp được chẩn đoán từ 1975 đến 2010. Nguy cơ mắc ALL cao nhất ở nhóm trẻ em dưới 5 tuổi. Nguy cơ mắc sau đó giảm chậm cho đến khoảng tuổi 20, và tăng chậm sau 50 tuổi. Tỉ lệ là 7,9/100.000 trẻ từ 1 đến 4 tuổi và 1,2 cho người lớn hơn 60. Chỉ 20% bạch cầu cấp ở người lớn là ALL, nhưng 1/3 trường hợp ALL là người lớn. Nguy cơ mắc ALL suốt đời trung bình là <1/750. Nguy cơ cao hơn ở nam so với nữ, người Mỹ da trắng so với da đen.
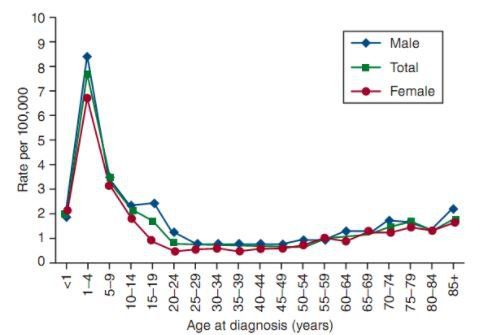
Tuổi chẩn đoán ALL trung bình là 13 tuổi và xấp xỉ 61% được chẩn đoán trước tuổi 20. Nhưng vì nó có hai đỉnh, nên con số 13 chỉ đúng về mặt toán học và gần như vô nghĩa với y học. ALL là bệnh lý ác tính phổ biến nhất được chẩn đoán ở người trẻ <15 tuổi, ước tính 23% tất cả các loại ung thư và 76% leukemia ở nhóm tuổi này.
Đỉnh sắc nhọn của tỉ lệ mắc ALL ở trẻ em đã quan sát được ở Anh quốc và Mỹ từ năm 1930. Ở Mỹ, đỉnh đầu tiên xuất hiện được quan sát ở trẻ có nguồn gốc châu Âu, tiếp sau đó là nhóm trẻ gốc châu Phi vào những năm 1960. Đỉnh mắc bệnh theo tuổi gần như không quan sát được ở nhiều nước đang hoặc chưa phát triển, gợi ý rằng yếu tố góp phần trong bệnh sinh của leukemia liên quan tới quá trình công nghiệp hóa. Ngoại trừ tỷ lệ ưu thế nhẹ ở nữ giới trong nhóm trẻ sơ sinh, ALL tác động lên nam giới có nguồn gốc châu Âu ưu thế ở tất cả các nhóm tuổi.
Tỷ lệ mắc ALL rất khác nhau giữa các vùng địa lý. Tỉ lệ cao ở cư dân vùng Bắc Âu, Tây Âu, Bắc Mỹ, châu Đại dương và thấp hơn ở châu Á, châu Phi.
2. Những yếu tố nguy cơ bệnh bạch cầu cấp tính dòng Lympho
2.1. Những hội chứng di truyền
Những biến cố sinh bệnh chính xác để dẫn đến ALL là chưa được hiểu rõ. Chỉ một phần nhỏ (5%) liên kết với các hội chứng di truyền. Trẻ em bị hội chứng Down có nguy cơ leukemia cao gấp 10-30 lần; Bạch cầu cấp dòng nguyên mẫu tiểu cầu chủ yếu ở trẻ <3 tuổi và ALL chủ yếu ở nhóm tuổi lớn. ALL ở bệnh nhân bị Down là một rối loạn không đồng nhất, bao gồm những dưới nhóm với những bất thường di truyền đã được xác định tương tự như trong dân số chung gồm đa bội >50 NST và t(12;21)[ETV6-RUNX1] và những bất thường phổ biến liên kết với hội chứng Down như +X, del(9), và tái sắp xếp CEBPD. Những nghiên cứu chỉ ra rằng tái tổ hợp gene P2RY8-CRLF2 và đột biến JAK hoạt hóa cùng góp phần trong bệnh sinh leukemia xấp xỉ một nửa trường hợp bệnh nhân hội chứng Down có ALL. Hầu như tất cả bệnh nhân ALL kèm hội chứng Down đều có delete gene IKZF1. Những bệnh lý di truyền lặn NST thường liên kết với tăng tính dễ đứt gãy chromosome và có khuynh hướng dễ mắc ALL là chứng thất điều – giãn mạch (ataxia-telangiectasia còn gọi là hội chứng Louis-Bar), Hội chứng đứt vỡ Nijmegen (Nijmegen breakage syndrome) và hội chứng Bloom. Bệnh nhân với chứng thất điều – giãn mạch có nguy cơ mắc leukemia cao gấp 70 lần và nguy cơ lymphoma cao gấp 250 lần, đặc biệt phenotype tế bào T. Gene sinh bệnh, ATM (ataxia-telangiectasia mutated), mã hóa cho protein liên quan đến sửa chữa DNA, điều hòa quá trình tăng sinh tế bào và apoptosis. Những nghiên cứu trên các thí nghiệm ủng hộ việc chẩn đoán chứng thất điều-giãn mạch bao gồm tăng nồng độ α-fetoprotein, sự hiện diện các bất thường NST đặc trưng, vắng hoặc giảm serin protein kinase ATM trong nhân tế bào và tăng nhạy cảm với bức xạ in vitro. Một tỷ lệ cao thay đổi gene ATM gặp ở trẻ em T-ALL gợi ý vài trò bệnh sinh của ATM trong bệnh lý ác tính dòng lympho. Mặc dù suy giảm miễn dịch góp phần làm tăng nguy cơ mắc bệnh lý ác tính liên quan đến nhiễm EBV ở người suy giảm miễn dịch mắc phải, không có bằng chứng thuyết phục rằng suy giảm miễn dịch đóng vai trò làm tăng nguy cơ mắc ALL ở bệnh nhân mắc chứng thất điều – giãn mạch hoặc những hội chứng suy giảm miễn dịch di truyền khác. Nghiên cứu tương quan toàn bộ hệ gene sự biến đổi alen phổ biến trong 4 gene (IKZF1, ARID5B, CEBPE, CDKN2a) là có mối liên kết hằng định với ALL ở trẻ em.
2.2. Những yếu tố môi trường
Tiếp xúc với tia X trong tử cung (nhưng không phải sau khi sinh) có nguy cơ tăng nhẹ ALL, tương quan dương với số lần phơi nhiễm. Bằng chứng yếu cho một mối liên hệ giữa sự phát triển ALL và bụi phóng xạ hạt nhân; tiếp xúc với phơi nhiễm bức xạ ion hóa nghề nghiệp, trên mặt đất hoặc vũ trụ; hoặc tiếp xúc với bức xạ của cha trước khi thụ thai. Đã có lo ngại rằng việc tiếp xúc với các trường điện từ năng lượng thấp được tạo ra bởi nguồn cung cấp năng lượng dân cư có thể liên quan đến sự phát triển của ALL trẻ em. Các nghiên cứu bệnh – chứng cho thấy nguy cơ mắc leukemia tăng nhẹ ở mức độ phơi nhiễm rất cao; giả định mối liên hệ là có thật, chỉ có khoảng 1 phần trăm leukemia có thể được quy cho việc phơi nhiễm. Phơi nhiễm thuốc trừ sâu (sử dụng nghề nghiệp hoặc tại nhà) và hút thuốc lá của cha mẹ trước hoặc trong khi mang thai, sử dụng vitamin K cho trẻ sơ sinh, tiêu thụ rượu của mẹ trong khi mang thai và tăng tiêu thụ nitrit trong chế độ ăn uống từng được đề xuất. Tuy nhiên, mỗi liên kết này đều gây tranh cãi và hầu hết đã bị bác bỏ sau khi điều tra cẩn thận, có kiểm soát. Cân nặng khi sinh cao có liên quan đến việc tăng nguy cơ mắc leukemia trước 5 tuổi với sự thống nhất hằng định, và cân nặng khi sinh có thể là dấu hiệu cho một yếu tố nội sinh, chẳng hạn như insulin-like growth factor.
2.3. Yếu tố vật chủ
Các đa hình di truyền của các enzyme chuyển hóa xenobiotic, con đường sửa chữa DNA và chức năng checkpoint chu trình tế bào có thể tương tác với các yếu tố môi trường, chế độ ăn uống, bà mẹ và các yếu tố bên ngoài khác ảnh hưởng đến sự phát triển của ALL. Mặc dù số lượng các nghiên cứu và kích thước mẫu bị hạn chế, dữ liệu tồn tại hỗ trợ vai trò nguyên nhân của đa hình trong các gen mã hóa các enzyme giải độc (ví dụ: glutathione S-transferase, nicotinamide adenine dinucleotide phosphate [NAD (P) H]: quinone oxyoreductase), các enzyme chuyển hóa folate (serine hydroxymethyltransferase và thymidylate synthase), cytochrom P450, methylenetetrahydrofolate reductase và các chất ức chế chu trình tế bào trong sự phát triển ALL trẻ em và người lớn. Tuy nhiên, tất cả các liên hệ này phải được xác nhận bởi các nghiên cứu lớn hơn với sự chú ý cẩn thận đến sự đa dạng về dân tộc và địa lý trong tần suất đa hình. Sử dụng phân tích trên toàn bộ bộ gen, đa hình đơn nucleotide (SNPs) của AT-rich interactive domain 5b (ARID5B) có liên quan đến B-cell precursor ALL đa bội ở trẻ em, một ví dụ rõ ràng về các biến thể di truyền của vật chủ ảnh hưởng đến sự phát triển ALL trẻ em.
2.4. Sự hình thành ALL trong bào thai
Hồi cứu của các fusion gene đặc hiệu leukemia (ví dụ, KMT2A/AFF1 [còn được gọi là MLL-AF4] và ETV6-RUNX1 [còn được gọi là TEL-AML1]), đa bội, hoặc tái sắp xếp Ig/TCR các giọt máu sơ sinh lưu trữ (Guthrie cards) và sự phát triển của leukemia đồng thời ở các cặp song sinh giống hệt nhau cho thấy rõ một số leukemia có nguồn gốc trước khi sinh. Trong các cặp song sinh cùng trứng với t(4;11)/KMT2A/AFF1, tỷ lệ phù hợp là gần 100 phần trăm và độ trễ (latency) trong thời gian xảy ra ở hai cặp song sinh là ngắn (vài tuần đến vài tháng). Những phát hiện này cho thấy fusion gene này một mình hoặc là leukemogenic hoặc chỉ cần một số lượng nhỏ các đột biến hợp tác để gây ra leukemia. Ngược lại, tỷ lệ phù hợp thấp hơn ở các cặp song sinh với fusion ETV6-RUNX1 hoặc kiểu hình tế bào T và thời gian trễ sau sinh dài hơn cho thấy các sự kiện sau sinh bổ sung được yêu cầu để chuyển dạng leukemic trong các subtype này. Lý thuyết này được hỗ trợ bởi việc xác định các tế bào hiếm biểu hiện các bản sao fusion ETV6-RUNX1 trong khoảng 1 phần trăm mẫu máu cuống rốn từ trẻ sơ sinh, tần số cao hơn 100 lần so với tỷ lệ ALL được xác định bởi bản sao fusion này.

Sự hiện diện của preleukemic clone với ETV6-RUNX1 đã được thiết lập. ALL đa bội, một subtype phổ biến khác của ALL trẻ em, cũng xuất hiện trước khi sinh nhưng đòi hỏi các sự kiện sau sinh để chuyển đổi ác tính hoàn toàn. Các quan sát về đỉnh tuổi phát triển ALL trẻ em từ 2 đến 5 tuổi, mối liên hệ với xã hội công nghiệp hóa, hiện đại hoá hoặc giàu có làm tăng tỷ lệ ALL, và các trường hợp rải rác leukemia ở trẻ em đã thúc đẩy hai giả thuyết dựa trên nhiễm trùng song song để tính đến các sự kiện sau sinh. Giả thuyết “nhiễm trùng muộn” (delayed-infection) đề xuất rằng một số cá nhân nhạy cảm với preleukemic clone mắc phải trước sinh không hoặc ít tiếp xúc với các nhiễm trùng thông thường đầu đời do sống trong môi trường vệ sinh cao. Cô lập nhiễm trùng như vậy dẫn đến hệ thống miễn dịch của những người này phản ứng bất thường hoặc bệnh lý sau khi tiếp xúc liên tục hoặc muộn với các bệnh nhiễm trùng thông thường ở độ tuổi tương xứng với sự tăng sinh tế bào lympho. Giả thuyết về “sự pha trộn dân số” (population-mixing) dự đoán rằng nhóm ALL trẻ em là hệ quả sự phơi nhiễm của các cá nhân nhạy cảm (không miễn dịch) với các tác nhân lây nhiễm phổ biến (nhưng không hoàn toàn gây bệnh) sau khi trộn lẫn với người lành mang trùng. Tuy nhiên, rõ ràng không phải tất cả các trường hợp leukemia thời thơ ấu đều phát triển trong tử cung. Ví dụ: t(1;19)/TCF3-PBX1 (còn được gọi là E2A-PBX1) ALL dường như có nguồn gốc sau sinh trong hầu hết các trường hợp. Các trường hợp ALL trưởng thành chắc chắn phát sinh trong một thời gian kéo dài.
3. Những thay đổi di truyền mắc phải
Bất thường genetic thu được là một dấu ấn của ALL; 80 phần trăm tất cả các trường hợp có các tổn thương cytogenetic hoặc molecular tái diễn liên quan đến tiên lượng và điều trị. Những thay đổi nhiễm sắc thể bao gồm sự bất thường về số lượng (ploidy) và cấu trúc của nhiễm sắc thể. Bất thường cấu trúc bao gồm chuyển vị (bất thường phổ biến nhất), đảo đoạn, mất đoạn, đột biến điểm và khuếch đại. Mặc dù tần số của các phân nhóm di truyền cụ thể khác nhau giữa các trẻ em và người lớn, các cơ chế chung về hiệu ứng là tương tự nhau. Các cơ chế bao gồm biểu hiện bất thường của oncoprotein, mất gen ức chế khối u và chuyển vị nhiễm sắc thể tạo ra các fusion gene mã hóa các yếu tố phiên mã hoặc kinase hoạt động.
Tái sắp xếp genetic nguyên phát tự thân nó không đủ để gây ra overt leukemia. Đột biến hợp tác là cần thiết để chuyển dạng leukemia và bao gồm những thay đổi genetic và epigenetic trong con đường điều hòa tăng trưởng quan trọng. Cách tiếp cận gen ứng viên đã xác định rõ việc delete các locus ức chế khối u CDKN2A/CDKN2B và các đột biến của NOTCH1 trong T-cell ALL. Các tìm kiếm hiện tại áp dụng phương pháp genome-wide microarray và high-throughput sequencing đã xác định được tần số cao của các thay đổi di truyền phổ biến ở cả B-cell precursor ALL và T-cell ALL. Sử dụng SNP microarray, trung bình 6,46 DNA copy number abnormalities (CNAs) cho mỗi trường hợp đã được xác định, cho thấy sự mất ổn định gen tổng thể không phải là một đặc điểm đối với hầu hết các trường hợp. Có sự khác biệt lớn về số lượng CNA giữa các leukemic subtype. Điều thú vị là các trường hợp ALL trẻ sơ sinh có tái sắp xếp MLL có ít hơn một CNA cho mỗi trường hợp, cho thấy rằng cần ít tổn thương di truyền bổ sung để hình thành leukemia trong trường hợp này. Ngược lại, các trường hợp ETV6-RUNX1 và BCR-ABL1 có hơn sáu CNA mỗi trường hợp, với một số trường hợp có hơn 20 tổn thương, một phát hiện phù hợp với ý niệm rằng. Mặc dù các sự kiện khởi đầu có thể xảy ra sớm ở thời thơ ấu, nhưng cần phải có thêm các tổn thương tiếp theo để phát triển ALL. Hơn 40% các trường hợp B-cell precursor ALL có đột biến các gen mã hóa các chất điều hòa sự phát triển lympho bình thường. Đích thường gặp nhất là yếu tố phiên mã lympho PAX5 (bị đột biến trong khoảng 32% trường hợp), mã hóa paired-domain protein cần thiết cho chuyển pro–B-cell thành pre–B-cell và sự ổn định dòng B. Gen liên quan thường xuyên thứ hai là IKZF1 (bị đột biến trong gần 28% trường hợp), mã hóa IKAROS zinc finger DNA-binding protein cần thiết cho sự biệt hóa lympho sớm nhất. IKZF1 đã bị delete trong phần lớn các trường hợp BCR-ABL1 ALL cũng như pha lymphoid blast crisis của bạch cầu mãn dòng tủy (nhưng không có trong giai đoạn mãn). Khoảng một nửa số trường hợp BCR-ABL1 ALL cũng có delete CDKN2A/B và PAX5. Phát hiện này tiếp tục ủng hộ ý niệm rằng nhiều đường truyền tín hiệu cần phải bị phá vỡ để gây ra leukemia. Một nhóm nhỏ ALL với kết quả rất kém có liên quan mạnh đến sự hiện diện của delete IKZF1. Tất cả những phát hiện này cho thấy IKZF1 liên quan trực tiếp đến khả năng kháng trị trong ALL.
BCR-ABL1-like B-cell ALL fusion BCR-ABL1 hoặc t (9; 22) bằng phân tích cytogenetic, FISH hoặc molecular, nhưng nó có chung gene-expression profile với BCR-ABL1–positive ALL điển hình. Trong một nửa các trường hợp này, gen CRLF2 có liên quan đến sự chuyển vị ẩn với gen IGH hoặc được hợp nhất với gen P2RY8; cả hai sự tái sắp xếp đều dẫn đến sự biểu hiện quá mức của CRLF2. Đột biến trong JAK2 hoặc JAK1 được phát hiện trong 30 đến 40 phần trăm các trường hợp này và nhiều trường hợp còn lại đã kích hoạt đột biến ở cytokine receptor và đường dẫn tín hiệu kinase. Microarrays và genomic DNA sequencing xác định monoallelic deletion của gen PAX5 ở 9p13.2 trong 28 phần trăm bệnh nhân ALL bị delete ẩn hoặc đoạn lớn hơn trong 9p.
Gene-expression profiling với các DNA microarrays cho phép gần như tất cả các trường hợp tế bào T được nhóm lại theo các con đường gây ung thư nhiều giai đoạn. Các nghiên cứu biểu hiện gen cũng cho thấy sự biểu hiện quá mức của FLT3, một receptor tyrosine kinase quan trọng cho sự phát triển của các tế bào gốc tạo máu, đây là một sự kiện thứ cấp trong hầu hết các trường hợp với sự tái sắp xếp MLL hoặc hyperdiploidy. Phát hiện này đã cung cấp một động lực để thử nghiệm lâm sàng các chất ức chế FLT3 trong ALL. Các tương tác trên toàn bộ bộ gen của cả leukemia cells và germline tissues đã xác định các biến thể di truyền khác có liên quan đến tiên lượng hoặc điều trị và có thể dẫn đến sự phát triển các điều trị đặc hiệu.
Những thay đổi epigenetic, bao gồm hypermethylation và im lặng các gen ức chế khối u và hypomethylation của oncogenes và bất thường trong các cơ chế kiểm soát hậu phiên mã, chẳng hạn như những người liên quan đến microRNA, là những phát hiện phổ biến trong ung thư. Những thay đổi này có thể đảo ngược và không làm thay đổi trình tự DNA, nhưng chúng có thể thay đổi biểu hiện gen theo những cách tinh tế khuyến khích sự biến đổi và tiến triển ác tính. Việc phân tích các thay đổi epigenetic đã bắt đầu được áp dụng để phát triển các dấu ấn sinh học mới để phân tầng nguy cơ hoặc theo dõi bệnh và thiết kế điều trị thay thế trong ALL. Bằng chứng chỉ ra rằng sự methyl hóa của nhiều gen trong ALL có liên quan đến một kết quả xấu hơn. Đáng ngạc nhiên, sự methyl hóa gen là nổi bật trong ALL trẻ em như người lớn. Sự khác biệt trong phản ứng của trẻ em và người lớn dường như không liên quan đến tổng lượng methyl hóa mà liên quan đến các gen cụ thể và các con đường cụ thể bị vô hiệu hóa. Các nghiên cứu sơ bộ về các hypomethylating agents (ví dụ, azacitidine và decitabine) đang được thử nghiệm ở bệnh nhân kháng với các thuốc hiện tại.

Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.