Bài viết bởi Tiến sĩ Lê Thị Thanh Hương - Viện Nghiên cứu Tế bào gốc và Công nghệ gen Vinmec.
Trong bài viết này, chúng ta sẽ tìm hiểu ứng dụng PCR kỹ thuật số (Droplet Digital TM PCR, ddPCRTM) cho quy trình sinh thiết lỏng trong chẩn đoán ung thư, theo dõi và đánh giá các phương thức điều trị cũng như phát hiện sự tái phát sau khi thuyên giảm.
1. Tóm tắt
Sinh thiết lỏng (liquid biopsy) là một phương pháp không xâm lấn được sử dụng để chẩn đoán và theo dõi tình trạng bệnh, bao gồm ung thư. Thay vì lấy sinh thiết tại mô bị ảnh hưởng, người ta thu thập “DNA tự do” (cell-free DNA - cfDNA), DNA khối u tuần hoàn (circulating tumor DNA- ctDNA; một tập con của cfDNA và có nguồn gốc từ trong khối u), hoặc tế bào ung thư dạng huyền phù (còn gọi là tế bào khối u tuần hoàn, circulating tumor cells, CTCs) từ máu hoặc các dịch cơ thể khác. PCR kỹ thuật số (Droplet Digital TM PCR, ddPCRTM) được ứng dụng cho quy trình sinh thiết lỏng trong chẩn đoán ung thư, theo dõi và đánh giá các phương thức điều trị cũng như phát hiện sự tái phát sau khi thuyên giảm.
2. Sinh thiết lỏng là gì?
Sinh thiết lỏng là các xét nghiệm không xâm lấn phát hiện các mảnh DNA hoặc tế bào trong máu hoặc các chất dịch cơ thể khác. Thuật ngữ “DNA tự do” (cfDNA) đề cập đến các mảnh DNA chủ yếu bắt nguồn từ các tế bào đang chết theo chu trình (apoptotic) và hoại tử. Các cfDNA lưu hành trong máu có thể được sử dụng để chẩn đoán một loạt các bệnh bao gồm ung thư, tiểu đường, và thậm chí là nhồi máu cơ tim, cũng như theo dõi các cơ quan cấy ghép trong người nhận. Trong trường hợp ung thư, cfDNA thường được gọi là DNA khối u tuần hoàn, hoặc ctDNA.
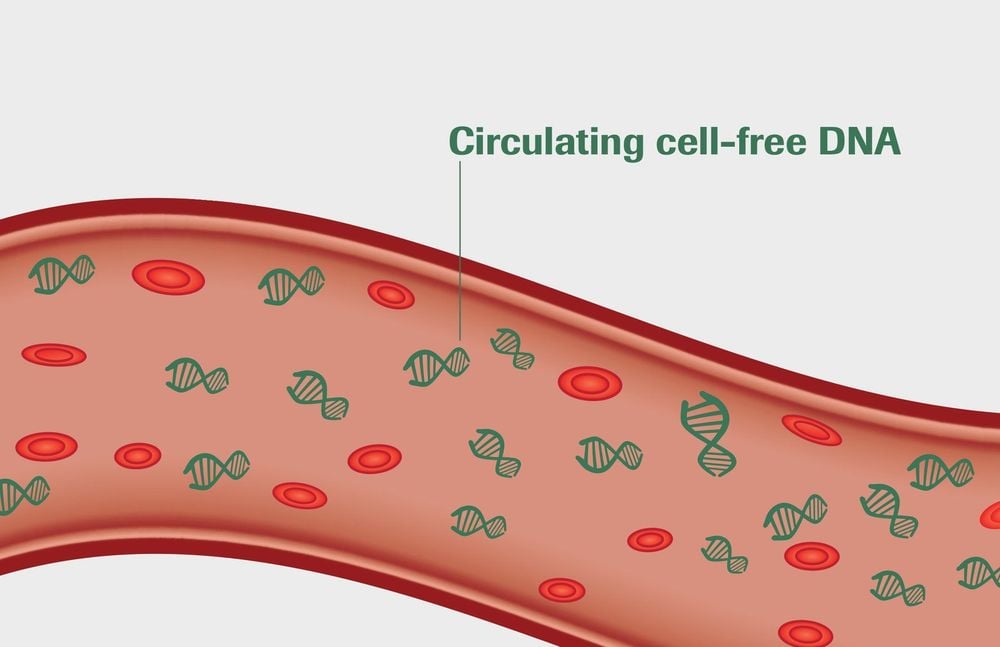
3. Ứng dụng sinh thiết lỏng trong chẩn đoán và theo dõi hiệu quả điều trị ung thư
Ngày nay, nghiên cứu và chẩn đoán ung thư là một trong những ứng dụng quan trọng của sinh thiết lỏng. Nhóm kỹ thuật này giúp giải quyết một số công việc cụ thể sau.
- Theo dõi và xác định các phác đồ điều trị – Sinh thiết lỏng có thể giúp bác sĩ theo dõi hiệu quả của một phác đồ điều trị, tối ưu hóa phác đồ, xác định xem những thay đổi trong phác đồ điều trị có mang lại lợi ích hay không.
- Giúp theo dõi các thay đổi trong khối u – Có nhiều khối u thay đổi liên tục theo thời gian; việc theo dõi những thay đổi này có thể giúp các bác sĩ đưa ra những thay đổi trong điều trị.
- Theo dõi sự tái phát – Giúp sàng lọc bệnh nhân đã thuyên giảm nhằm phát hiện khối u mới phát triển trước khi các dấu hiệu thể chất xuất hiện rõ ràng, cho dù khối u xuất hiện ở cùng vị trí cũ hoặc di căn sang vị trí khác.
- Thường xuyên sàng lọc các bệnh nhân có nguy cơ cao – Với một số người có kiểu gen liên quan đến ung thư, sinh thiết lỏng có thể giúp phát hiện sớm ung thư trước khi triệu chứng lâm sàng xuất hiện hoặc được phát hiện bằng các kỹ thuật chụp ảnh thông thường.
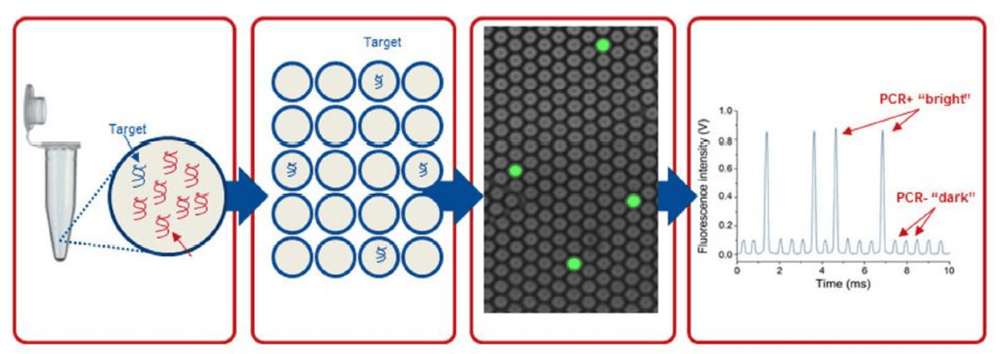
Mục tiêu của sinh thiết lỏng là phát hiện và định lượng các cfDNA, ctDNA và CTC có mang đột biến lưu hành trong máu. Tuy nhiên những trình tự đích này thường hiện diện ở mức thấp và xung quanh chúng còn có các thành phần phức tạp khác như tế bào bạch cầu, DNA bình thường từ các tế bào già yếu của cơ thể, v.v... Ngoài ra, DNA tuần hoàn thường bị phân mảnh cao, nên hàm lượng trình tự đích còn nguyên vẹn cũng sẽ không cao. Những thách thức này đòi hỏi các kỹ thuật sàng lọc đột biến cần có độ nhạy cao hơn để có thể phát hiện và định lượng các trình tự đích có hàm lượng thấp trong thời gian ngắn. PCR kỹ thuật số hay PCR vi giọt kỹ thuật số (Droplet DigitalTM PCR, ddPCRTM) hiện đang là một công cụ phù hợp cho sinh thiết lỏng. Đây là một công nghệ mới, cho phép định lượng tuyệt đối các trình tự đích với độ nhạy và độ chính xác cao.
4. PCR vi giọt kỹ thuật số (ddPCR)
Một quy trình PCR vi giọt kỹ thuật số bao gồm 5 bước cơ bản.
- Chuẩn bị phản ứng PCR: Việc chuẩn bị phản ứng ddPCR tương tự như phản ứng PCR thông thường. Phản ứng cũng bao gồm các thành phần cơ bản như enzyme Taq polymerase, mồi, dNTP, ma-giê, v.v... và bổ sung thêm chất phát quang EvaGreen hoặc mẫu dò huỳnh quang TaqMan. Các mẫu DNA sẽ được bổ sung vào các phản ứng này. Cũng giống như khi chạy PCR, bên cạnh các phản ứng cho mẫu xét nghiệm, kỹ thuật viên thường chạy thêm các phản ứng mẫu đối chứng dương (chứa DNA đích) và phản ứng đối chứng âm (không chứa DNA đích).
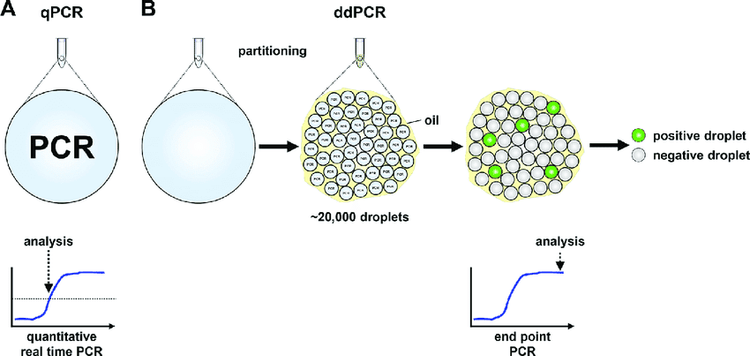
- Tạo vi giọt: Bằng một thiết bị đặc biệt gọi là Droplet Generator, một phản ứng sẽ được phân chia ngẫu nhiên thành các vi giọt có thể tích khoảng 1 nL. Mỗi vi giọt này chứa đầy đủ các thành phần của 1 phản ứng Real-time PCR. Các phân tử DNA sẽ được phân bố ngẫu nhiên vào các vi giọt này.
- Nhân bản DNA có trong vi giọt: Tất cả vi giọt được tạo ra từ 1 phản ứng ban đầu sẽ được chuyển vào 1 giếng trong đĩa PCR 96 giếng và được đặt vào máy PCR thông thường. Khi chương trình luân nhiệt diễn ra, DNA có trong mỗi vi giọt sẽ được nhân bản như một phản ứng PCR thông thường. Tín hiệu huỳnh quang tạo ra do mẫu dò hoặc chất phát quang sẽ được tích tụ trong từng vi giọt,
- Đọc tín hiệu trong vi giọt: Sau khi phản ứng PCR kết thúc, các vi giọt sẽ được phân tích bởi một thiết bị đọc huỳnh quang. Từng vi giọt trong mỗi ống chứa ở bước 3 sẽ được hút vào đường ống của thiết bị và lần lượt đi qua các đầu đọc tín hiệu huỳnh quang. Cường độ tín hiệu của mỗi màu huỳnh quang có trong mỗi vi giọt sẽ được đầu đọc ghi nhận lại.
- Phân tích dữ liệu: Kết quả đọc của tất cả vi giọt được tạo ra từ từng phản ứng ban đầu sẽ được chuyển sang phần mềm phân tích trên máy vi tính. Đối với từng phản ứng 20 μL ban đầu, kết quả được phân tích bao gồm:
- Tổng số vi giọt (droplet) tạo ra từ phản ứng ban đầu, bao gồm vi giọt dương tính và vi giọt âm tính.
- Tổng số vi giọt dương tính (chứa DNA đích và có cường độ tín hiệu huỳnh quang cao hơn hẳn so với những vi giọt trong phản ứng chứng âm).
- Tổng số vi giọt âm tính (không chứa DNA mục tiêu và có cường độ tín hiệu huỳnh quang ngang ngửa với những vi giọt trong phản ứng chứng âm)
Dựa vào số lượng vi giọt dương tính và tổng số vi giọt tạo ra từ mỗi phản ứng ban đầu, phần mềm sẽ áp dụng mô hình phân phối Poisson để tính ra nồng độ DNA đích có trong thể tích phản ứng ban đầu.
5. Ứng dụng PCR kỹ thuật số trong phát hiện và theo dõi ung thư
Ngày nay, có nhiều công trình trên thế giới đã và đang ứng dụng PCR kỹ thuật số trong phát hiện và theo dõi nhiều loại ung thư khác nhau. Qua các ví dụ bên dưới, bạn đọc sẽ hình dung được các ứng dụng PCR kỹ thuật số cũng như độ nhạy tuyệt vời của kỹ thuật này.
Ung thư phổi tế bào không nhỏ
Ung thư phổi không tế bào nhỏ (NSCLC) là dạng ung thư phổi phổ biến nhất. NSCLC mang những đột biến hoạt hóa thụ thể yếu tố tăng trưởng biểu bì (EGFR) và đáp ứng với các thuốc ức chế tyrosine kinase. Có nhiều đột biến hoạt hóa EGFR khác nhau, và sau một thời gian điều trị, phần lớn các NSCLC trở nên kháng lại với thuốc ức chế kinase. Hiện tượng kháng thuốc này được gây ra chủ yếu bởi đột biến thứ cấp EGFRT790M. Chính vì vậy, ngoài việc xác định những đột biến EGFR, hiện nay các bác sĩ cho rằng cần kiểm tra sự xuất hiện của những đột biến thứ cấp trong quá trình điều trị. Trong công trình năm 2015 của mình, Zhu và cộng sự đã ứng dụng PCR kỹ thuật số để phân tích ctDNA và giúp tăng độ nhạy lâm sàng đối với các đột biến hoạt hóa EGFR lên 80%. Ngoài ra, PCR kỹ thuật số còn cho phép phát hiện đột biến thứ cấp EGFRT790M ở tỷ lệ thấp (Oxnard và cộng sự, 2014, Watanabe và cộng sự, 2015, Zhang và cộng sự 2015) trước khi khối u phát triển trở lại do hiện tượng kháng với các chất ức chế tyrosine kinase.

Ung thư da ác tính
Khoảng 50% các khối ung thư da ác tính có mang đột biến chuyển đổi valine thành glutamic acid tại codon 600 của serine/threonine kinase B-Raf (một loại gen tiền gây ung thư). Những bệnh nhân mang đột biến này được điều trị bằng thuốc ức chế BRAF. Mức độ cfDNA lưu hành trong máu có chứa đột biến này rất thấp (<0,01% của cfDNA). Tuy nhiên, thời gian qua đã có công trình ứng dụng PCR kỹ thuật số để phát hiện loại đột biến BRAFV600E này và đạt được độ nhạy đến mức 0,005%. Công trình này cũng ứng dụng PCR kỹ thuật số để chứng minh mối tương quan giữa các mức phần trăm đột biến BRAFV600E trong các khối u và trong cfDNA (Sanmamed và cộng sự, 2015). Thêm vào đó, ở những bệnh nhân được điều trị bằng thuốc ức chế BRAF, mức độ giảm BRAFV600E ctDNA sẽ tương ứng với mức độ phá hủy các khối u và ngược lại sự tăng mức độ phần trăm ctDNA BRAFV600E sẽ là dấu hiệu của hiện tượng kháng với phương pháp điều trị. Nghiên cứu của Sanmamed và cộng sự đã chứng minh rằng hoàn toàn có thể ứng dụng PCR kỹ thuật số để xác định những bệnh nhân có khả năng đáp ứng với phương pháp điều trị bằng thuốc ức chế BRAF cũng như theo dõi quá trình điều trị của họ sau đó.

Ung thư vú
Trong ung thư vú, vì tỷ lệ bệnh nhân bị tái phát sau phẫu thuật là đáng kể nên các bác sĩ có thể chỉ định điều trị thêm bằng xạ trị và/hoặc hóa trị để tiêu diệt những tế bào khối u còn sót lại. Beaver và cộng sự đã ứng dụng PCR kỹ thuật số để phân tích mẫu ctDNA trước và sau phẫu thuật ung thư vú. Nhóm nghiên cứu đã được phát hiện ctDNA trong một số mẫu sau phẫu thuật (Beaver và cộng sự, 2014). Điều này cho thấy rằng hiện tượng vi di căn vẫn còn hiện diện trong các mẫu này và chúng ta có thể ứng dụng PCR kỹ thuật số để phát hiện các khối u rắn còn sót lại (Siravegna và Bardelli, 2014). Từ đây, chúng ta có thể tính khả thi khi ứng dụng PCR kỹ thuật số để phát hiện mức độ thấp của ctDNA nhằm dự đoán nguy cơ tái phát sau phẫu thuật ung thư vú và đưa ra các quyết định về hình thức chăm sóc sau phẫu thuật phù hợp.
Video đề xuất:
Tài liệu tham khảo
- Beaver JA et al. (2014). Detection of cancer DNA in plasma of patients with early-stage breast cancer. Clin Cancer Res 20, 2643–2650. PMID: 24504125
- Oxnard GR et al. (2014). Noninvasive detection of response and resistance in EGFR-mutant lung cancer using quantitative next-generation genotyping of cell-free plasma DNA. Clin Cancer Res 20, 1698–1705. PMID: 24429876
- Sanmamed MF et al. (2015). Quantitative cell-free circulating BRAFV600E mutation analysis by use of droplet digital PCR in the follow-up of patients with melanoma being treated with BRAF inhibitors. Clin Chem 61, 297–304. PMID: 25411185
- Siravegna G and Bardelli A (2014). Minimal residual disease in breast cancer: in blood veritas. Clin Cancer Res 20, 2505–2507. PMID: 24658155
- Watanabe M et al. (2015). Ultra-sensitive detection of the pretreatment EGFR T790M mutation in non-small cell lung cancer patients with an EGFR-activating mutation using droplet digital PCR. Clin Cancer Res epub ahead of print. PMID: 25882755
- Zhang B et al. (2015). Comparison of droplet digital PCR and conventional quantitative PCR for measuring EGFR gene mutation. Exp Ther Med 9, 1383–1388. PMID: 25780439
- Zhu G et al. (2015). Highly sensitive Droplet Digital PCR method for detection of EGFR-activating mutations in plasma cell-free DNA from patients with advanced non-small cell lung cancer. J Mol Diagn 17, 265–272. PMID: 25769900
XEM THÊM:
- Tìm hiểu về phương pháp sinh thiết lỏng ctDNA chẩn đoán ung thư
- Tân sinh trong biểu mô cổ tử cung (CIN): Những điều cần biết
- Tế bào ung thư hình thành, phát triển và lan rộng như thế nào?
Để đặt lịch khám tại viện, Quý khách vui lòng bấm số HOTLINE hoặc đặt lịch trực tiếp TẠI ĐÂY. Tải và đặt lịch khám tự động trên ứng dụng MyVinmec để quản lý, theo dõi lịch và đặt hẹn mọi lúc mọi nơi ngay trên ứng dụng.